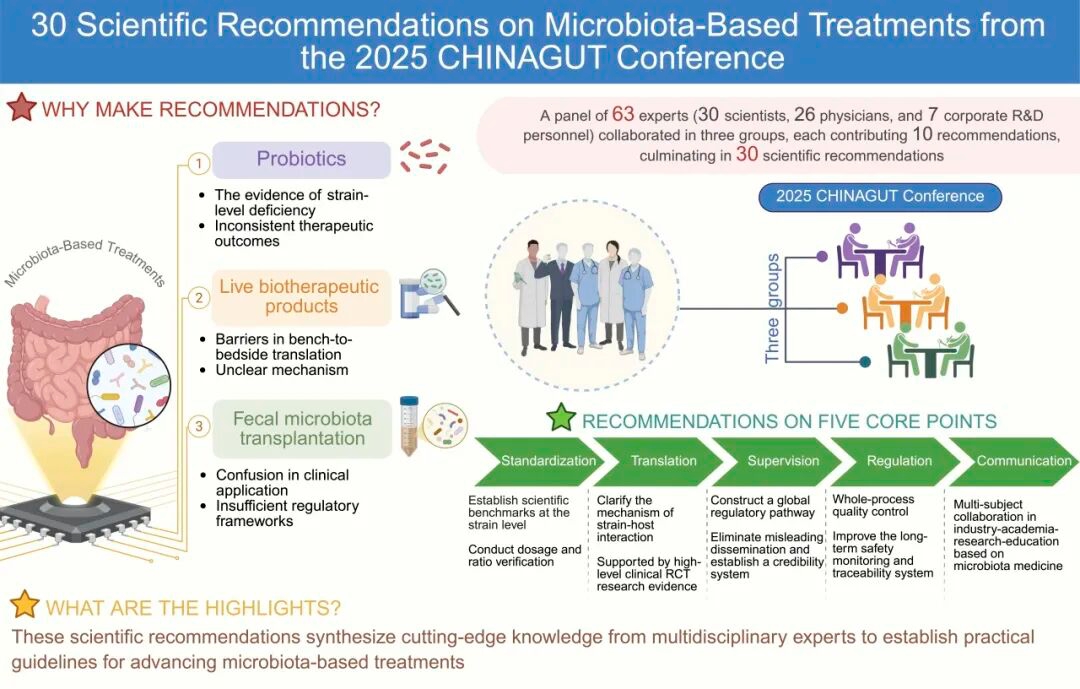
日前,全国数十位微生态领域的产、学、研专家,共同发表题为《塑造益生菌、活体生物药和粪菌移植的未来:来自中国肠道大会的30条科学建议(Shaping the future of probiotics, live biotherapeutic products, and fecal microbiota transplantation: 30 scientific recommendations from the CHINAGUT Conference)》的文章。
文章旨在促进益生菌、活体生物药及粪菌移植发展,致力于从标准化、转化、监管、质控以及合作等关键问题出发,为学科与产业的未来提供标准化的发展框架。未知君联合创始人、CEO谭验博士作为国内微生态制药行业代表,以作者身份参与讨论并联署了“推动活体生物药产业发展的十大科学建议”。目前,该文章已在知名学术期刊iMeta在线发表。

近年来,活体生物药(LBPs)作为一种前景广阔的治疗策略崭露头角,因其调节宿主微生物群并引发治疗效应的潜力而备受关注。然而,许多LBPs的作用机制仍不明确,这为理性药物设计、靶向患者选择和监管评估带来了困难。此外,由于缺乏标准化的生物标志物用于患者分层和疗效评估,LBPs临床试验的设计更加复杂。与此同时,LBPs的生产工艺复杂,质量管控难度大且成本高昂。这些挑战因LBPs特有的难题而进一步加剧,例如严格厌氧菌的培养、浓度与给药剂量的确定,以及实现高效生产的障碍。
为此,包括谭验博士在内的专家小组,提出了旨在推动LBPs临床转化与广泛应用的十条科学建议。
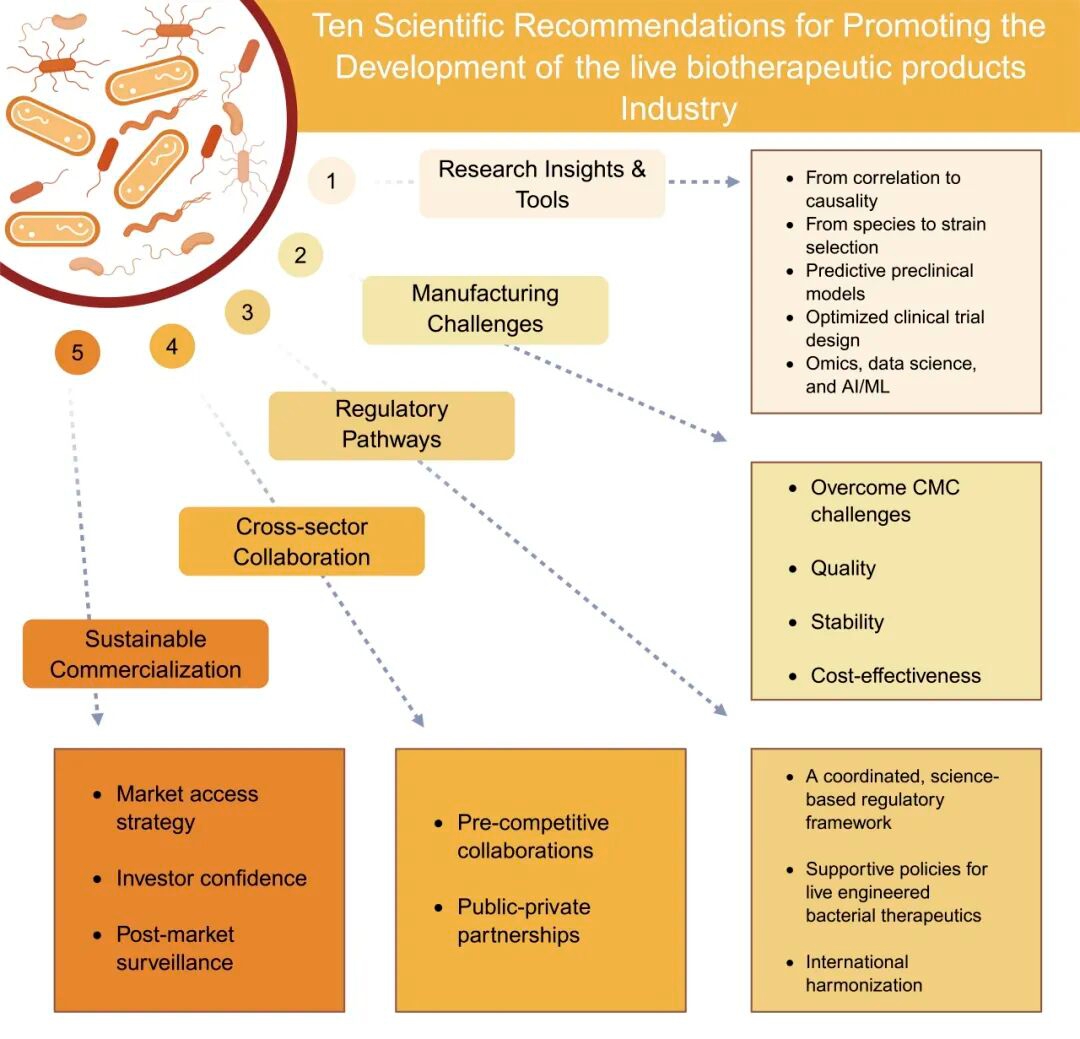
推动活体生物药产业发展的十大科学建议
1. 深化机制认知——从相关性到因果性,从菌种到菌株选择
优先级:3-5年长期目标
未来活体生物药研究应实现三大转向:从相关性分析转向机制研究,识别LBPs靶向的特定功能因子、代谢通路及宿主受体/通路;在无法充分模拟人体相关机制时(如宿主-微生物互作、微生物代谢物与免疫调节等),需采用无菌和悉生动物模型、类器官、多组学和系统生物学阐明LBPs的分子与细胞机制;对于低风险应用场景,应考虑采用离体肠道模型等已验证替代方案,平衡科学严谨性与可行性。推进机制研究需要底层技术的突破,包括非模式微生物的功能预测与基因组编辑技术,尤其需关注同一菌种内不同菌株的功能变异性。随后通过早期临床试验的实际给药验证机制假说,结合患者微生物组与宿主反应的动态监测建立因果链。清晰的MoA认知能降低研发风险,实现基于特定靶点的菌株选择,并提升动物模型预测能力。此外,还能将基于机制的生物标志物纳入临床试验,加速监管审批,提高医生认可度,并增加支付方报销可能性。
2. 创新并验证临床前模型以促进成功转化
优先级:3-5年长期目标
由于宿主个体间微生物组和免疫反应的差异,传统动物模型往往无法准确预测LBPs在人体中的疗效。缺乏预测性临床前模型是LBP临床试验高失败率的主要原因。改进后的模型有助于候选药物筛选、剂量优化和早期安全性识别,从而提高临床成功率。研究重点应放在能以人类相关方式研究LBP定植、持久性、功能活性及与宿主免疫系统相互作用的模型上。应开发先进的离体、体外和体内临床前模型,以模拟人类肠道(或其他部位,如阴道、皮肤等)的生理状态、菌群失调和疾病状态。人源化微生物组动物模型、肠道芯片系统和复杂共培养系统在这方面已展现出良好应用前景。
3. 战略临床开发——优化试验设计、终点指标与患者分层策略
优先级:3-5年长期目标
采用具有临床意义且客观的适应性创新双盲试验设计,通过生物标志物进行患者分层以提高试验效率与成功率。经初步验证的生物标志物需通过独立临床队列验证其预测价值。LBP试验面临微生物群变异性和疾病复杂性的双重挑战,“一刀切”方案难以奏效。终点指标应具备稳健性并真实反映患者获益。根据基线微生物组特征、免疫反应、宿主代谢、宿主遗传学或其他生物标志物对患者分组,有助于识别最可能对LBPs产生应答的亚群。开发预测性生物标志物对实现个性化LBPs及改善试验结果至关重要。
4. 整合组学技术、数据科学与人工智能(AI)/机器学习(ML),推动下一代个性化活体生物药发展
优先级:3-5年长期目标
在条件允许的情况下,系统性地将AI和ML与多组学技术相结合,以加速LBP的发现、优化开发流程并实现个性化治疗策略。微生物群的多样性及宿主-微生物相互作用产生了海量数据集,包括基因组学、转录组学、蛋白质组学和代谢组学数据。AI/ML擅长分析这些大规模数据集,可用于预测新分离菌株的表型特征,阐明未报道菌株的分子和细胞机制,识别新型治疗靶点,预测LBP疗效,发现患者分层的生物标志物,优化制剂配方并简化生产工艺。这种数据驱动的方法对下一代LBP研发至关重要。AI/ML是应对LBP开发中复杂性和变异性挑战的潜在变革性工具。例如,基于机器学习的建模可用于预测和设计高产丁酸盐的微生物群落用于疾病治疗。
5. 攻克化学、制造与控制(CMC)难题,确保质量、可扩展性、稳定性和成本效益
优先级:3-5年长期目标
LBPs的CMC策略的核心在于:针对不同给药途径(如口服、外用或注射),需采用具有差异生理特性的活菌制剂开发多种剂型。CMC开发策略应根据各阶段需求(包括临床前、早期临床、后期临床及商业化阶段)进行定制化设计。
需重点突破活体微生物(常为厌氧菌)生产过程中的挑战,包括发酵工艺、稳定性及外源因素控制。开展关键质量属性研究并制定相应质量标准。严格关注菌株活性、遗传稳定性、效价测定、制剂稳定性,以及在GMP条件下实现成本效益的大规模生产。创新表征分析和效价检测方法至关重要,质量源于设计(QbD)与过程分析技术(PAT)有助于保障产品一致性与质量。
对于工程菌株,需建立遗传稳定性监测系统,并设计生物安全开关以防止环境泄漏。优先采用基于同源重组(而非质粒表达)的遗传稳定性策略以降低突变率。建议整合环境传感器(如温度、pH值、代谢物)设计布尔逻辑电路(如与/或门)作为实践指导。
6. 主动开展战略合作,推动监管路径的协调统一与流程优化
优先级:1-3年内的短期目标
确保与全球监管机构保持早期且持续的沟通,以获取明确指导、参与指南制定,并倡导建立适合LBPs特性的协调统一、基于科学的监管框架。活体生物药存在进入环境和健康人群的潜在风险,临床试验需考虑生物泄漏风险并建立生物安全控制策略。当前活体生物药的监管体系尚在演变中,具体要求有待明确。基于患者特异性特征设计的工程菌为个性化活菌疗法提供了有效途径,但目前针对基因工程菌的临床试验缺乏相关标准,需要配套政策和清晰的行业标准来推动活体工程菌治疗产品的临床研究。通过积极对话可解决活体生物药特有的挑战,如效价测定、稳定性要求、新菌株安全性评估及非临床测试策略等。借助国际人用药品注册技术协调会(ICH)等平台推动国际协调,可减少重复工作并促进全球开发。行业协会与科研机构在建立共识性标准与最佳实践指南方面可发挥关键作用。清晰且可预测的监管路径有助于增强投资信心,加速活体生物药的开发进程。
7. 促进学术界、产业界、监管机构与患者群体间的建设性参与和对话
优先级:需在1年内采取行动的当务之急
LBP领域尤其不适合传统的孤立研发模式。协作能整合资源、分担风险并加速知识积累。应积极建立并参与竞争前合作与公私合作伙伴关系,共享知识、资源与风险,从而加速LBP的研发进程。LBP开发的复杂性需要多领域专业能力支撑——学术机构推动药物发现与机制研究,生物技术公司开展工艺创新与早期开发,大型药企提供后期试验与商业化资源,CRO/CDMO提供专业服务,监管机构给予指导,患者权益团体则提供洞见支持。竞争前合作可解决共性挑战(如生物标志物验证、标准化分析方法开发或共享数据库建设),同时不损害企业竞争优势。
8. 战略性铺平市场准入道路:通过价值证明融入医疗体系
优先级:3-5年的长期目标
在研发初期就应制定全面战略,向支付方、医师和患者证明LBPs的临床与经济价值,并推动其融入现有医疗体系。市场准入是活体生物药面临的主要壁垒,获取医保报销和临床采纳构成重大挑战。价值证明不仅需要坚实的临床证据(疗效与安全性),还需包含卫生经济学结果、能否改善患者生活质量的明确数据,以及与现有标准疗法的对比数据。对医疗从业者开展活体生物药作用机制、疗效、安全性及适用场景的教育,对消除质疑、实现精准患者筛选至关重要。应尽早与支付方接洽,了解其证据要求并建立合理的定价与报销模式。以证据为基础、积极主动的市场准入策略与科研开发具有同等重要性。
9. 重燃并维持投资者信心——政策引导与商业投资双管齐下
优先级:1-3年内的短期目标
作为具有颠覆性潜力的新兴领域,LBP研发在技术攻关、产业化和商业化层面面临多重挑战。通过构建“政策-资本-生态”三位一体的嵌套式设计,不仅能借助政策引导助力早期研发跨越“死亡之谷”,更能筛选出真正具有临床价值的技术路线。通过重点展示科研突破、风险缓释策略、清晰的市场路径及务实的商业预期,建立高影响力的阶段性成果通报机制,将有效加强活体生物药研发界与投资界的对话。
10. 通过教育、透明度和完善的市场后证据建立信任与认可
优先级:3-5年长期目标
积极开展面向医疗专业人员、患者和公众的透明沟通与教育工作,并辅以强有力的市场后监测和真实世界证据生成。建立信任对于任何新型治疗类别的采用都至关重要,特别是涉及活体微生物的疗法。需要提供关于LBPs清晰、准确且易于理解的信息——包括其定义、作用机制、益处和潜在风险——以弥合知识差距并解决临床医生和患者的误解。临床试验结果(包括积极和消极两方面)和生产流程的透明度可以增强公众对LBPs的信心。获批后完善的真实世界证据能进一步验证长期安全性和有效性,支持将LBPs纳入临床指南和保险支付范围。积极的公众教育和开放对话有助于消除对LBPs的神秘感并建立信任。
未知君:用扎实成绩促行业发展
iMeta称,本文是在2025中国肠道大会期间,由63位专家组成的三个专题小组经过讨论后形成的30条科学建议,旨在促进益生菌、活体生物药及粪菌移植发展。谭验博士受邀参与《推动活体生物药产业发展的十大科学建议》的讨论及联署,展现了科学界、产业界对未知君在微生态药物研发领域所取得成绩的认可。
未知君是目前国内领先的专注于肠道微生态治疗的AI制药公司,拥有自主搭建的AI微生物组研究与产业转化平台——通过底层生信平台、AI平台与自动化、高通量的湿实验平台的“干湿结合”,实现更高效的LBPs发现、更深入的药物机制研究、更清晰的MoA认知。
目前,未知君已有四条药物管线进入临床阶段,其中两条先后在中、美进入临床二期。根据第三方统计,未知君XBI-302药物管线是亚洲第一个在美国FDA获得IND临床批件的FMT药物。LBP01是亚洲范围首个进入临床一期、国内首个进入临床二期的基因工程菌药物管线。KEX02药物管线是国内率先获得美国FDA临床批件的微生物活体药物(LBP)管线之一(数据来源:Informa Pharma Intelligence,国家药品监督管理局药品审评中心)。
同时,未知君基于制药级研究平台,可在益生菌研发、FMT粪菌移植等微生态应用方向上,赋能广大慢病、亚健康人群及大健康行业伙伴。在FMT方向,未知君开发个性化肠道微生态精准治疗项目,与医院、功能医学机构合作,瞄准大健康市场;益生菌研发方面,未知君开展功能菌株发现、功能评价、工艺开发,赋能益生菌和大健康企业的上游研发工作。目前,未知君已与IFF、美赞臣(中国)、WonderLab万益蓝、茶颜悦色等国内外头部大健康、食品饮品公司完成商业合作。
与全国学界、产业界顶尖专家加强沟通、交流,推动行业标准的确立与完善,建立一套协调、统一的监管流程与标准体系,素来是未知君的行业责任与使命。期待此次的科学建议,将有助于解决LBPs当前发展中的核心问题,推动其在临床实践中的广泛应用与可持续发展,为患者提供更安全有效的治疗选择;为行业科学、健康、高效发展提供宝贵参考。
-End-